کلرواستیک اسید، زیرا لندن پراکندگی لندن را به نیروهای پراکندگی لندن نیرو می دهد (LDF، همچنین به عنوان نیروهای پراکندگی، نیروهای لندن، نیروهای دوقطبی القا شده از دوقطبی آنی، پیوندهای دوقطبی القایی نوسانی یا ضعیف به عنوان ون شناخته می شود. نیروهای der Waals) نوعی نیرویی هستند که بین اتمها و مولکولهایی که معمولاً از نظر الکتریکی متقارن هستند، اعمال میشود یعنی الکترون ها … https://en.wikipedia.org › wiki › London_dispersion_force
نیروی پراکندگی لندن - ویکی پدیا
در بین مولکول های آن ضعیف تر است. اسید کلرواستیک، زیرا نیروهای دوقطبی دوقطبی در بین مولکول های آن ضعیف تر است. اسید یدوستیک، زیرا نیروهای پراکندگی لندن در بین مولکولهای آن قویتر است.
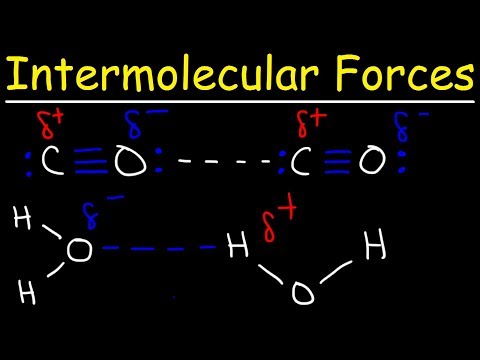
چه نیروهای بین مولکولی در اسید استیک وجود دارد؟
در اسید استیک (با فرمول شیمیایی $C{{H}_{3}}COOH$)، دارای سه نوع نیروی بین مولکولی است که عبارتند از: پیوند هیدروژنی ، برهمکنش های دوقطبی-دوقطبی و نیروی پراکندگی. این نوع خاصی از پیوند هیدروژنی قوی دارد.
اسید هیدروکلریک چه نیروی بین مولکولی است؟
دو نیروی بین مولکولی در HCl وجود دارد: دوقطبی-دوقطبی و نیروهای پراکندگی لندن. از این دو، نیروهای دوقطبی-دوقطبی قوی تر هستند. نیروهای دوقطبی-دوقطبی ناشی از دوقطبی پیوند H-Cl است (چون کلر الکترونگاتیوتر از H است).
نیروهای بین مولکولی در آب و اسید استیک چیست؟
آب پیوندهای هیدروژنی قوی دارد. اسید استیک مانند آب دارای پیوندهای هیدروژنی قوی است. در اسید استیک جامد، مولکولها جفتهای حلقوی ایجاد میکنند که با پیوندهای هیدروژنی به هم متصل شدهاند.
آیا اتانوئیک اسید دوقطبی است؟
در اسید استیک (CH3COOH)، پیوند هیدروژنی، برهمکنش دوقطبی-دوقطبی و نیروی پراکندگی وجود دارد در حالی که در تتراکلرید کربن وجود دارد. (CCl4) فقط نیروهای غیر قطبی پراکندگی وجود دارند.