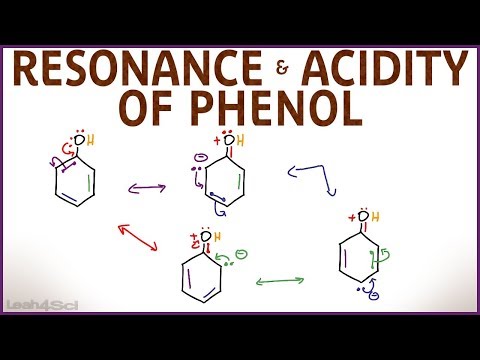
فنل هیدروکسی بنزن است که دارای پروتون روی گروه هیدروکسیل (OH) است. … به دلیل جابجایی الکترون، آنیون (باز مزدوج A اسید مزدوج حاوی یک اتم H بیشتر و یک بار + بیشتر از پایه ای که آن را تشکیل داده است یک باز مزدوج حاوی یک H کمتر است. اتم و یک بار بیشتر از اسیدی که آن را تشکیل داده است. … یک اتم H کمتر و یک بار بیشتر دارد. بنابراین OH- باز مزدوج H2O است. https://socratic.org › اسیدهای مزدوج-و- پایه های مزدوج
اسیدهای مزدوج و بازهای مزدوج - شیمی | سقراطی
) تثبیت می شود (نسبت به یک الکل آلیفاتیک)، و بنابراین مولکول فنل خود اسیدی تر از یک الکل آلیفاتیک است..
چرا متا هیدروکسی بنزوئیک اسید اسیدی تر است؟
گروه
OH که هر دو گروه -I و +R هستند به عنوان گروه -I در موقعیت متا عمل می کنند و الکترون را بیرون می کشند بنابراین چگالی الکترون در COO- و در نتیجه اسیدیته آن کاهش می یابد. بیشتر از بنزوئیک اسید خواهد بود که اثر حذف الکترون ندارد. بنابراین متا هیدروکسی بنزوئیک اسید اسیدی تر از اسید بنزوئیک است.
چرا M هیدروکسی بنزوئیک اسید قوی تر از اسید p-هیدروکسی بنزوئیک است؟
وقتی گروه -OH به موقعیت para متصل می شود، تمایل دارد الکترون های خود را به سمت حلقه آروماتیک (یعنی بنزن) تغییر مکان دهد. بنابراین چگالی الکترون روی اتمهای اکسیژن گروه کربوکسیلیک افزایش مییابد و قطبیت بین O و H کاهش مییابد که منجر به اسیدیته کمتر میشود.
چرا دو هیدروکسی بنزن کربوکسیلیک اسید اسیدی تر از بنزن کربوکسیلیک اسید هستند؟
بنابراین برای پاسخ به سوال شما، اسید ارتو هیدروکسی بنزوئیک اسیدی تر است زیرا در ایزومر ارتو، پل هیدروژنی قوی بین -OH- فنلی و یون کربوکسیلات تشکیل می شود و این تمایل به تثبیت باز کربوکسیلات مزدوج و در نتیجه افزایش اسیدیته دارد.
چرا پارا هیدروکسی بنزوئیک اسید کمتر از بنزوئیک اسید است؟
اثر رزونانس در مقایسه با اثر القایی قویتر است، افزایش خالص در چگالی الکترون در موقعیتهای o-و p- وجود دارد، بنابراین p-هیدروکسی بنزوئیک اسید کمتر است. اسیدی از اسید بنزوئیک.
(A) p-Hydroxy benzoic acid has a lower boiling point than o-hydroxy benzoic acid. (R) a-Hydroxy